Au cœur des hommes
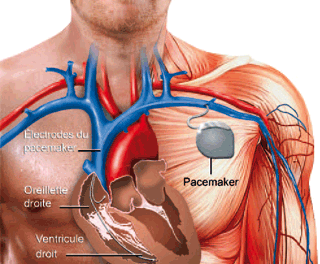
Le pacemaker : imposer un rythme au cœur.
Un pacemaker, implanté dans la poitrine, sert à stimuler le cœur par des impulsions électriques lorsque celui-ci ne « bat pas bien » et ainsi déclenche les contractions cardiaques.
© Wahid Mendil, CRDP de l’académie de Versailles.
Système implantable, le pacemaker se substitue au système électrique du cœur pour des patients souffrant de bradycardie. Il envoie des impulsions électriques de manière à provoquer une contraction cardiaque. Les dernières générations de pacemaker sont équipées d’un capteur mesurant l’activité électrique du cœur et envoient une impulsion électrique quand cela fait un certain temps que le capteur n’a pas détecté de contraction. Il arrive même que le pacemaker se substitue complètement à la fonction cardiaque. Comme le rythme cardiaque d’une personne augmente de manière importante quand celle-ci fait un effort, le pacemaker est équipé de capteurs qui mesurent le mouvement de la personne et le rythme de la respiration pour estimer son niveau d’activité physique. L’algorithme de contrôle transforme l’ensemble des mesures effectuées sur le patient pendant un intervalle de temps en une valeur de rythme cardiaque à imposer, afin d’adapter le débit sanguin à l’effort physique fourni, comme pour un cœur de personne bien portante.
La santé est une préoccupation importante de notre société, qui est prête à investir dans la recherche afin d’en faciliter les progrès. Cela concerne aussi bien la médecine que la chirurgie. L’automatique permet de créer des outils qui aident le médecin à prendre des décisions, en calculant par exemple la quantité de médicaments qu’il faut donner à un patient. Des robots téléopérés permettent de dupliquer le geste chirurgical et d’en augmenter la précision. Dans certains cas, le système automatique peut aussi prendre seul des décisions. C’est le cas des systèmes médicaux implantés dans le corps humain ou de certains robots porteurs d’outils chirurgicaux qui se déplacent automatiquement pour réaliser un geste planifié à l’avance ou pour suivre les mouvements des organes.
Une posologie adaptée
Quand une maladie se déclare chez un patient, la médecine dispose de moyens, les traitements thérapeutiques, pour agir sur la maladie. Chaque traitement, un médicament par exemple, doit être dispensé à juste dose pour chaque patient de manière à assurer un effet thérapeutique optimal. La posologie (la dose de médicament à prendre et le mode d’administration) est adaptée à chaque patient. Pour cela, des modèles pharmacocinétiques-pharmacodynamiques (PK-PD) sont développés par des laboratoires pharmaceutiques. Ces modèles décrivent le lien entre la dose de médicament délivrée et l’évolution de la concentration du médicament dans le sang au cours du temps ainsi que le lien entre la concentration dans le sang et l’intensité de l’effet du médicament. Ils sont réglés par des paramètres numériques qui sont calculés pour différentes populations de patients (une population de patients est un ensemble de patients ayant tous les mêmes caractéristiques, par exemple leur poids se situe dans la même tranche).
Administrer la juste dose
Grâce au modèle PK-PD, il est possible de prédire l’évolution de l’effet du médicament au cours du temps en fonction de la dose administrée. On peut alors calculer à quels intervalles de temps il va falloir réadministrer du médicament et avec quel dosage, à l’aide d’un algorithme d’optimisation. L’objectif de l’algorithme est de proposer une posologie permettant de garantir l’effet du médicament au cours du temps tout en minimisant son éventuelle action toxique : c’est un problème de « commande optimale en boucle ouverte ». « Optimale », car on cherche à optimiser plusieurs critères. « En boucle ouverte », car le profil d’administration est calculé initialement à partir du modèle, sans réadaptation du profil à partir de mesures réalisées sur le patient au cours du traitement. L’utilisation d’algorithmes de commande optimale est d’autant plus pertinente que l’action thérapeutique est réalisée en combinant plusieurs médicaments.
Comme souvent pour les phénomènes biologiques, l’action du médicament peut varier d’un patient à l’autre, même s’ils appartiennent à la même population de patients. On appelle ce phénomène la « variabilité interindividuelle ». Cela se traduit par le fait que l’évolution de l’effet du médicament observée chez un patient n’est pas exactement conforme à celle prédite par le modèle. Cela peut poser problème quand l’objectif thérapeutique est très précis, si on cherche par exemple à maintenir la concentration du médicament dans une zone réduite. Il faut alors trouver des solutions pour adapter les paramètres du modèle sur le patient, en mesurant des variables biologiques à l’aide de prélèvements sanguins. Une application très stimulante dans ce domaine est le traitement des cancers par chimiothérapie ou radiothérapie.
Au secours de l’organisme défaillant
Certaines maladies se traduisent par l’incapacité de l’organisme à réaliser correctement une fonction physiologique vitale. L’objectif de la médecine moderne est alors de développer des systèmes capables de suppléer l’organisme. Il s’agit de réaliser des systèmes implantés dans le corps du patient qui vont prendre le relais de l’organe déficient.
Un système médical implanté doit nécessairement être composé de trois éléments :
- un (ou plusieurs) capteur(s) permettant de mesurer des informations sur le patient, afin d’en déduire son état physiologique ;
- un actionneur permettant d’agir sur le corps humain ;
- un algorithme de contrôle qui, à partir des données enregistrées par les capteurs, va décider de l’action à entreprendre.
Bien sûr, dans le corps humain, rien n’est jamais simple. Contrairement à une machine, où l’objectif d’un algorithme de régulation est de maintenir une variable à une valeur fixée, les variables physiologiques varient de manière naturelle en fonction du cycle jour-nuit, de l’heure de la journée, de l’activité de la personne. Le système implantable doit tenir compte de cette variabilité pour que le patient puisse avoir un confort de vie aussi proche que possible de celui d’une personne bien portante.
Un pancréas artificiel
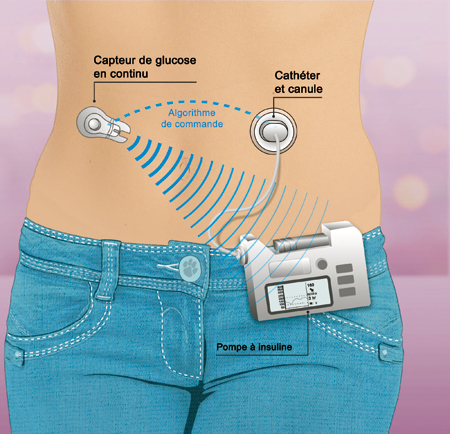
Réguler la glycémie automatiquement, schéma de fonctionnement d’un pancréas artificiel.
Le « pancréas artificiel » mesure en continu la glycémie, puis ajuste et délivre la dose d’insuline nécessaire pour ramener le taux de sucre dans le sang à la normale. Ce système en cours de développement permettrait aux diabétiques de mieux vivre avec cette maladie chronique.
© Wahid Mendil, CRDP de l’académie de Versailles.
Tout récemment, des chercheurs de Boston ont développé et testé un algorithme de contrôle en boucle fermée chez des patients diabétiques hospitalisés. Le système délivre à la fois de l’insuline et du glucagon en fonction de la concentration de glucose mesurée toutes les cinq minutes. Le système est complètement autonome, il n’est pas nécessaire d’indiquer la quantité de glucide contenue dans chaque repas. Un algorithme détermine le dosage de glucagon afin d’éviter que la concentration en glucose tombe sous une valeur limite. Une commande prédictive règle le dosage en insuline. Le système de régulation a été appliqué sur onze patients pendant vingt-sept heures, chaque patient a fait trois repas riches en glucides au cours de l’expérience. Des résultats satisfaisants ont été obtenus sur six patients. Pour les cinq autres, des phases d’hypoglycémie ont été observées, qu’il a fallu traiter en leur donnant du jus d’orange. D’après les chercheurs, cela viendrait du fait que le modèle pharmacocinétique utilisé n’était pas bien adapté à ces cinq patients.
Un exemple de système implantable actuellement à l’étude est le pancréas artificiel. Il permettrait de traiter les patients souffrant de diabète de type 1. Chez ces patients, la capacité à réguler la glycémie (la concentration en glucose dans le sang) est déficiente. Le pancréas n’est plus capable de sécréter d’insuline (une hormone permettant de faire baisser la concentration en sucre dans le sang) ni de glucagon (une hormone à action antagoniste à l’insuline). Un patient souffrant de diabète 1 doit régulièrement s’injecter de l’insuline artificielle de manière à maintenir son taux de glycémie à une valeur acceptable pour l’organisme. Actuellement, les patients souffrant de ce diabète sont équipés d’une pompe à insuline qui délivre en continu une concentration prédéfinie en insuline. Avant chaque repas, le patient doit évaluer son taux de glucose dans le sang à l’aide d’un prélèvement sanguin effectué au bout d’un doigt. En fonction de la valeur relevée et de l’estimation de l’apport en glucose que va générer le repas qu’il va faire, un algorithme calcule la dose d’insuline à délivrer pour maintenir la glycémie à un niveau acceptable, à l’aide d’un modèle pharmacocinétique adapté à ce patient. Ce traitement est assez contraignant et n’est pas optimal. Le développement d’un pancréas artificiel faciliterait grandement la vie de ces patients. Aujourd’hui, des capteurs de glucose implantables, permettant de mesurer le glucose toutes les minutes, sont disponibles. Des études sont réalisées pour développer un algorithme de contrôle en boucle fermée qui calculerait la dose d’insuline à injecter en fonction de la mesure en continu du glucose. Plusieurs algorithmes ont été développés, qui donnent des résultats prometteurs. Un des problèmes restant à résoudre est l’adaptation de l’algorithme au patient car le modèle pharmacocinétique de l’insuline varie en fonction du patient, et peut être différent pour un même patient au cours du temps. Mais ce qui constitue probablement le plus grand frein à la mise en œuvre du pancréas artificiel est la fiabilité du système. En effet, une erreur de mesure de glucose pourrait générer un mauvais dosage de l’insuline par le contrôleur et avoir des conséquences très graves sur la santé du patient. Avant d’envisager l’implantation sur patient, le système développé devra avoir prouvé sa robustesse face aux erreurs éventuelles des différents éléments constituant la boucle de commande.
Les robots opérants
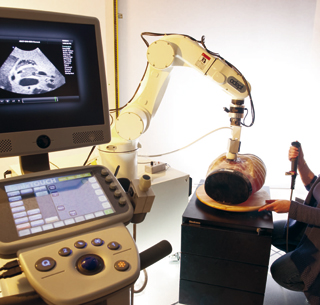
Plateforme expérimentale de l’équipe Lagadic, Inria Rennes.
Ce robot, à partir d’images obtenues par une sonde échographique, analyse les mouvements de respiration du patient (représenté ici par le mannequin), pour ensuite assister les gestes du chirurgien en fonction de ces mouvements.
© Inria / Photo Kaksonen.
L’imagerie ultrasonore possède trois principaux atouts. Elle permet une imagerie anatomique en temps réel, non invasive et à faible coût. Néanmoins, la qualité des images échographiques est faible et rend difficiles leur interprétation et leur traitement. L’utilisation de cette modalité pour commander des robots médicaux par asservissement visuel a démarré aux alentours de l’an 2000. Les applications concernent soit le guidage de la sonde échographique, soit le guidage d’un instrument ou d’une aiguille observée par la sonde. La plupart des approches reposent sur l’utilisation d’informations visuelles géométriques qui sont extraites de l’image par des techniques de segmentation. Récemment, une nouvelle méthode a été proposée par des chercheurs pour s’affranchir de cette étape de segmentation. Elle utilise directement l’information d’intensité des pixels contenus dans une région d’intérêt pour déplacer automatiquement une sonde échographique robotisée afin de stabiliser l’image lors d’un examen.
C’est dans le domaine de la chirurgie orthopédique que les premiers systèmes robotiques sont apparus au milieu des années 1980. Ils réalisaient, de manière autonome à partir d’un planning préopératoire, l’usinage précis de la cavité osseuse nécessaire au placement de prothèses de genou ou de hanche. À la fin des années 1990 sont arrivés des dispositifs robotiques téléopérés qui permettent de dupliquer le geste du médecin. La téléopération consiste à commander à distance un robot manipulateur dit « esclave » actionnant un ou plusieurs instruments chirurgicaux au moyen d’une console de commande dite « maître ». Cette console mesure les déplacements d’instruments fictifs actionnés manuellement par le chirurgien et les transmet au robot « esclave ». Le chirurgien peut ainsi réaliser son intervention à distance, à partir d’un retour visuel de la scène opératoire qui lui est fourni par un écran vidéo. Ces systèmes sont couramment utilisés en microchirurgie et chirurgie laparoscopique (opération de l’abdomen par de petites incisions) car ils permettent de démultiplier et de filtrer les mouvements des mains du chirurgien pour augmenter la précision du geste chirurgical. La téléopération est également utilisée pour réaliser des examens à distance. Il existe actuellement des robots légers porteurs d’une sonde échographique, qui se posent sur l’abdomen du patient et qui opèrent à distance, guidés par un expert de la pathologie concernée.
Guidage par système de navigation
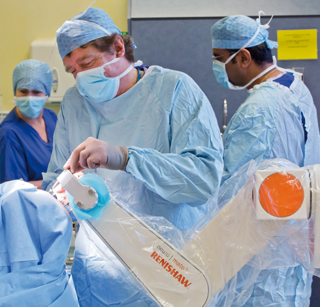
Le robot Neuromate® : un système stéréotaxique guidé par l’image et piloté par l’ordinateur.
Ce bras articulé, couplé à un ordinateur, assiste le neurochirurgien à la fois dans ses mouvements et par la prise d’images, pendant l’opération, apportant des données précieuses sur le patient. Il est notamment utilisé pour traiter certains symptômes de la maladie de Parkinson.
© Renishaw®Mayfield.
Les systèmes de navigation sont couramment utilisés en neurochirurgie. Dans le but de traiter des pathologies telle la maladie de Parkinson, l’opération consiste à insérer une aiguille de biopsie pour atteindre une zone profonde du cerveau ou à introduire un guide qui permet de déposer des électrodes de stimulation. Le geste est réalisé manuellement ou à l’aide d’un dispositif robotique porteur d’outil comme le robot Neuromate® présenté sur la photo ci-dessus. Les systèmes de navigation sont également utilisés pour assister le médecin lors d’actes médicaux sous contrôle radiologique : insertion d’aiguille dans un organe afin de prélever des tissus ou traiter localement des tumeurs par radiothérapie ou cryoablation. Cette insertion d’aiguille est pour l’instant réalisée manuellement par le chirurgien à l’aide d’un système de navigation, mais plusieurs prototypes de robots ont déjà été proposés par des équipes de recherche pour réaliser cette tâche avec plus de précision.
Depuis une dizaine d’années, l’émergence des techniques d’imagerie a permis d’envisager de nouvelles applications robotiques d’assistance aux gestes médicaux. Il est à présent possible d’utiliser l’information provenant d’une ou de plusieurs modalités d’imagerie telles l’endoscopie, l’échographie, l’imagerie à rayonnement X, ou l’imagerie à résonance magnétique (IRM) pour guider des robots médicaux. Actuellement, une grande majorité des interventions réalisées sous imagerie médicale repose sur l’utilisation d’un système de navigation pour localiser la position d’un instrument chirurgical dans le référentiel de l’imageur. La cible à atteindre peut être directement visible dans l’image per-opératoire (obtenue durant l’intervention) ou projetée dans celle-ci après avoir effectué un recalage d’une image pré-opératoire du patient, dans laquelle a été planifiée la cible à atteindre, avec l’image per-opératoire observée. Généralement, ce recalage est réalisé au moyen d’un algorithme d’optimisation qui met en correspondance des marqueurs artificiels ou anatomiques observés dans les deux images (pré et per-opératoires). La précision du geste est donc directement fonction, d’une part, de la précision du système utilisé pour localiser l’outil et, d’autre part, de la précision de la procédure de recalage. L’erreur de positionnement est également plus grande lorsque la cible réelle à atteindre est mobile, ce qui est généralement le cas en raison des perturbations induites par les mouvements physiologiques du patient.
Ajustement à vue
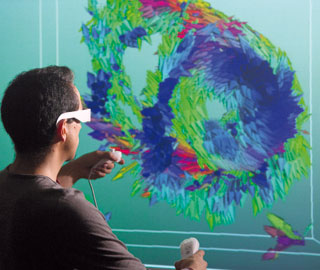
L’imagerie médicale tridimensionnelle permet de visualiser et de mesurer de manière interactive de nombreux paramètres.
Ici l’étude porte sur l’architecture 3D in vivo des fibres myocardiques du cœur humain. Centre de recherche en acquisition et traitement de l’image pour la santé, Villeurbanne.
© CNRS Photothèque – FRESILLON Cyril.
La commande d’instruments robotisés par asservissement visuel a un avantage majeur. Elle permet de compenser les perturbations introduites par la respiration ou le mouvement cardiaque du patient. Actuellement, des recherches sont menées afin de permettre la réalisation d’interventions chirurgicales telles que le pontage de l’artère coronaire sur cœur battant à l’aide d’un système robotique téléopéré par le chirurgien. L’approche consiste à synchroniser les déplacements de la caméra endoscopique et des instruments laparoscopiques avec les mouvements du coeur, de sorte que le chirurgien puisse opérer sur un cœur virtuellement stabilisé. Dans cette optique, des asservissements visuels rapides ont été développés et testés pour synchroniser automatiquement les déplacements des instruments chirurgicaux avec celui du cœur.
La commande par vision ou asservissement visuel est une approche alternative aux techniques de recalage classiques. Plusieurs équipes de recherche ont proposé son utilisation dans des applications médicales. Elle permet de commander directement à partir d’informations visuelles extraites de l’image médicale per-opératoire, et en boucle fermée, soit le déplacement de l’imageur soit celui d’un instrument. Le principe de cette commande est d’adapter le déplacement du robot de manière à minimiser une erreur visuelle qui est directement mesurée à chaque instant dans l’image per-opératoire. Cette erreur peut par exemple correspondre à la distance entre un instrument et une cible à atteindre qui sont détectés par un algorithme de traitement d’image. Néanmoins, pour sa mise en œuvre, il est nécessaire que les images per-opératoires soient rafraîchies à une cadence proche de celle de la vidéo (25 images/seconde). Pour cette raison, deux types d’imagerie ont été principalement considérés pour l’instant : d’une part l’imagerie optique utilisant des capteurs vidéo (caméras) comme par exemple l’endoscopie, la fibroscopie, la microscopie, d’autre part l’imagerie échographique. Les premiers travaux ont porté sur le positionnement automatique d’un robot porteur d’un endoscope afin de suivre et maintenir dans le champ visuel de la caméra un ou plusieurs instruments de chirurgie laparoscopique lors d’une intervention chirurgicale, évitant ainsi la présence d’un chirurgien pour manipuler l’endoscope.
Ces dernières décennies, les sciences et technologies de l’information et de la communication ont permis à la médecine de faire des progrès immenses dans de nombreux secteurs. Elles ont amélioré la prise en charge thérapeutique et donné un meilleur confort de vie aux patients souffrant de maladies chroniques. Les avancées technologiques dans le domaine de l’informatique et de l’instrumentation vont permettre de traiter des informations de plus en plus complexes, dans des délais de plus en plus courts, à l’aide de systèmes de plus en plus petits. Elles vont ainsi révolutionner le monde de la médecine avec la création de systèmes implantables. Les résultats de la recherche en robotique médicale vont également permettre la réalisation de nouveaux gestes chirurgicaux.
- Kalant H., Grant D., Mitchell J., Principles of Medical Pharmacology, Elsevier, 2006.
- Taylor R., Menciassi A., Fichtinger G., Dario P., « Medical Robots and Systems », Springer Handbook of Robotics, Springer, 2008.
- Troccaz J., Robotique médicale. Traité Systèmes Automatisés, IC2, Hermes-Lavoisier, 2012.
- La robotique dans la médecine, TPE : étude de la robotique qui assiste les patients et les médecins dans la médecine
- Futura-Santé, « Un pancréas artificiel prototype mais prometteur pour les diabétiques »
Cet article est paru dans la revue DocSciences n°15 Entre les hommes et les machines : automatique et traitement du signal, éditée par le CRDP de l’Académie de Versailles, en partenariat avec Inria et le CNRS, à l’initiative du comité éditorial d’Interstices.
Newsletter
Le responsable de ce traitement est Inria. En saisissant votre adresse mail, vous consentez à recevoir chaque mois une sélection d'articles et à ce que vos données soient collectées et stockées comme décrit dans notre politique de confidentialité
Niveau de lecture
Aidez-nous à évaluer le niveau de lecture de ce document.
Votre choix a été pris en compte. Merci d'avoir estimé le niveau de ce document !

Sylvie Charbonnier

Alexandre Krupa