Fusion d’images : des outils au service des neurochirurgiens
Le cerveau est un organe à part, puisque chaque zone correspond à une fonction : motricité, langage, vision, etc. Les structures cérébrales doivent être considérées sous un double aspect anatomique et fonctionnel.
Pour préparer son intervention, le neurochirurgien doit définir la zone cible, c’est-à-dire localiser l’emplacement de la lésion, mais aussi les zones à éviter, qui sont les zones fonctionnelles proches, ainsi que des zones de repère, permettant de se repérer dans les images et dans la réalité, et enfin une trajectoire d’accès, qui peut par exemple suivre des sillons corticaux.
Un travail d’équipe
Autrefois, le neurochirurgien se basait sur des informations génériques, telles que des atlas anatomiques du cerveau publiés sur papier, et sur sa propre expérience. Depuis quelques années, il peut disposer des données concernant le patient qu’il doit opérer, fournies par différents dispositifs d’imagerie. Les images pré-opératoires sont principalement obtenues par imagerie par résonance magnétique (IRM) pour les aspects anatomiques, et par tomographie d’émission de positons (TEP), par tomographie d’émission monophotonique (TEMP), par magnétoencéphalographie (MEG) ou par IRM fonctionnelle (IRMf) pour les aspects fonctionnels. Pour repérer dans ces images les informations utiles, l’informatique intervient. Plus précisément, le système développé par les chercheurs en informatique de l’équipe INSERM-INRIA VisAGeS à Rennes, et notamment Pierre Jannin, chercheur à l’INSERM, sert à mettre en correspondance les images obtenues, à en extraire les données utiles pour l’opération, et enfin, à les présenter au neurochirurgien de la façon la plus ergonomique possible.
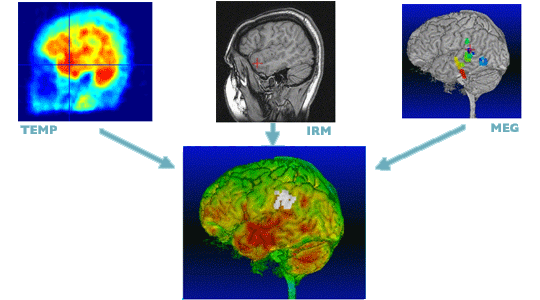
Recalage d’images : une image multimodale est obtenue à partir des images provenant de différents dispositifs.
Images : équipe VisAGeS.
La méthodologie choisie pour développer ce système est itérative. Elle part des besoins des médecins afin de spécifier des outils, puis réalise des prototypes et les évalue techniquement et cliniquement en salle d’opération. Enfin, les résultats de cette évaluation font progresser les spécifications. L’efficacité de cette méthode tient au fait qu’elle est mise en œuvre par une équipe de recherche pluridisciplinaire, associant des neurochirurgiens et des informaticiens, qui ont appris ensemble à partager les mêmes préoccupations et le même langage. Les industriels de l’imagerie sont aussi impliqués au travers de thèses CIFRE (Conventions Industrielles de Formation par la Recherche). Les développements s’appuient ainsi sur les appareils existants, ce qui est réaliste par rapport aux contraintes économiques.
Planifier l’intervention
Pour repérer les différentes zones importantes pour l’opération, le neurochirurgien se base sur une vue tridimensionnelle du cerveau, obtenue à partir d’images pré-opératoires.
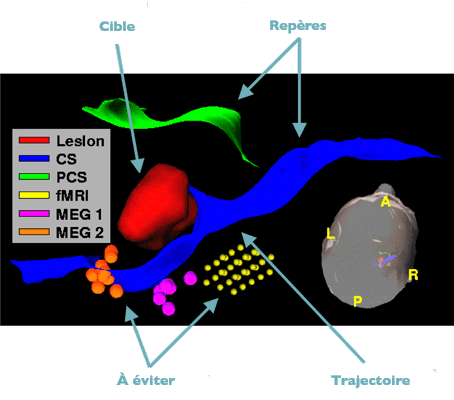
Planification d’une intervention chirurgicale : pour préparer la procédure à réaliser, les zones cibles, les zones à éviter, les zones de repère, les trajectoires, sont définies à l’aide d’images multimodales.
Image : équipe VisAGeS.
À partir de l’IRM et d’images TEMP, on dispose de deux volumes orientés différemment, et on souhaite les combiner en un seul. La mise en correspondance des images est effectuée par des techniques de recalage d’images. Le principe de base est de repérer un certain nombre de structures dans le premier volume, et les structures qui leur correspondent dans le second. Par exemple, on repère 3 points dans l’IRM et les points correspondants dans les images TEMP.
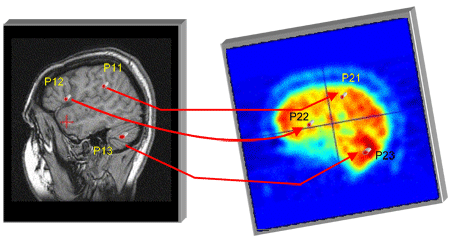
Le problème est de calculer la transformation F, qui combine rotation et translation, telle que F(image1) = image2.
Ce calcul de F s’effectue sachant que :
F(P11) = P21
F(P12) = P22
F(P13) = P23.
Image : équipe VisAGeS.
On cherche ensuite les transformations – combinaisons de translations et de rotations – qui permettent de passer des uns aux autres, en essayant d’obtenir la meilleure. D’un point de vue mathématique, il s’agit donc de définir une fonction de coût, et une méthode d’optimisation qui permet de converger vers la meilleure solution possible. Cette mise en correspondance peut aussi utiliser directement les niveaux de gris des images.
De la même manière, on recale les images IRMf et TEP, si elles sont disponibles. Ensuite, on extrait des différentes images les structures qui intéressent les chirurgiens. On parle de « segmentation » de structures dans les images. Puis, tous les objets segmentés à partir des images multimodales sont regroupés dans une même image 3D.
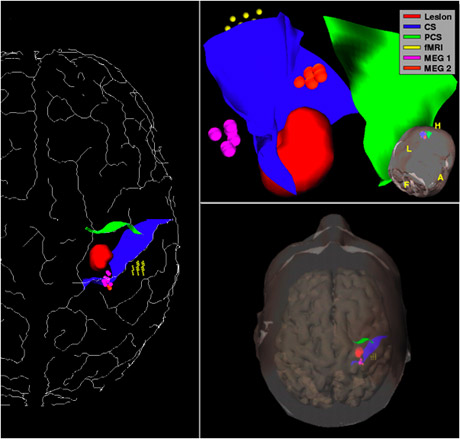
En rouge, la lésion à ôter, qui est ici un cavernome. En bleu, le sillon central, un des plis importants reconnaissables à la surface du cerveau, et qui servira de chemin d’accès vers le cavernome. En orange, jaune et rose, les zones fonctionnelles de motricité et de somesthésie à éviter lors de la chirurgie.
Images : équipe VisAGeS.
En salle d’opération
Rendre les données disponibles pendant l’opération s’avère le plus délicat. Pour les informaticiens, le fait de travailler en synergie avec les neurochirurgiens révèle ici tous ses avantages.
Installation en salle d’opération.
Photo J.J. Levrel – CHU Rennes.
Il faut en effet mesurer à quel point la salle d’opération est un milieu particulier, où tous les dispositifs convergent vers un seul but : assister le neurochirurgien dans son intervention. Il est exclu d’encombrer l’espace par des appareillages volumineux. Au contraire, il convient de proposer une solution qui modifie le moins possible les habitudes des neurochirurgiens. Comme le neurochirurgien opère à travers le microscope chirurgical, les informaticiens ont choisi de présenter les informations venant de l’imagerie en les superposant sur l’image du patient qui est vue dans ce microscope. Les informations extraites des images sont représentées sous forme de contours de couleur.
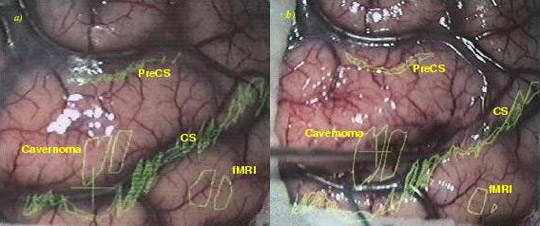
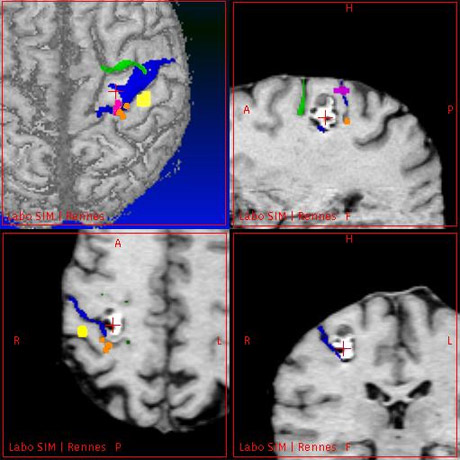
Superposition des informations provenant de l’imagerie sur la vue du patient, à travers le microscope chirurgical. On retrouve les contours du cavernome, le sillon central et les données fonctionnelles à éviter.
Image : équipe VisAGeS.
À nouveau, ce sont des techniques de mise en correspondance géométrique qui sont utilisées pour recaler les images. Les points de repère, matérialisés par des pastilles collées sur le crâne du patient, sont visibles sur les images pré-opératoires, et sont repérés en salle d’opération à l’aide d’un système de neuronavigation. On les pointe avec un outil en forme de crayon, dont la position est détectée par triangulation à partir des images de trois caméras.
Malheureusement, les choses ne restent pas aussi simples lors de l’intervention. Lorsque le neurochirurgien ouvre la boîte crânienne, se produit un phénomène d’affaissement du cerveau, appelé brain-shift en anglais, qui rend obsolètes les informations acquises avant l’opération.
Or il n’est pas envisageable de recommencer l’acquisition des données. Il devient donc nécessaire de mettre à jour les images acquises avant l’intervention, afin de prendre en compte la déformation du cerveau. Une solution consiste à utiliser un dispositif léger et rapide, comme une échographie par exemple, afin d’obtenir de nouvelles informations succinctes, et de les fusionner avec les indications plus précises provenant des images pré-opératoires.
Mais la déformation est telle qu’un recalage rigide n’est pas possible. Il faut utiliser une technique plus complexe, de recalage non rigide, non linéaire, qui calcule la déformation en chaque point de l’image. Un tel calcul de recalage pourra être nécessaire plusieurs fois au cours de l’opération.
Vers la neurochirurgie guidée par l’image
Présenter la bonne information au bon moment pour aider le neurochirurgien, c’est ce qui guide le développement des techniques informatiques de fusion d’images. Dans ce but sont aussi élaborés des modèles de procédure chirurgicale. En effet, si les grandes étapes de la chirurgie sont connues a priori, il devient possible d’anticiper ce que le neurochirurgien aura besoin de voir lors de ces différentes étapes. Et si cette connaissance est couplée avec le logiciel de visualisation d’images, alors l’accès aux images et le mode de représentation peuvent être adaptés en fonction de ces besoins.
Dans le contexte de la chirurgie, il est indispensable d’évaluer avec rigueur le fonctionnement global du système ainsi que la précision spatiale de chacun de ses composants. Aujourd’hui, ce dispositif de neurochirurgie guidée par l’image est utilisé expérimentalement au Centre hospitalier universitaire de Rennes pour certaines interventions. Le bénéfice pour le patient ne fait pas de doute. Des lésions peuvent être opérées à un stade plus précoce. Et les zones fonctionnelles sont mieux préservées, ce qui améliore la qualité de vie du patient après l’intervention.
Les recherches se poursuivent, afin de continuer à enrichir l’information fournie aux neurochirurgiens, en intégrant de nouvelles modalités d’imagerie, qui permettent de mieux caractériser les zones lésionnelles. Pour aller encore plus loin dans l’aide à la prise de décision et à l’action.
Ce document a été rédigé d’après les indications de Pierre Jannin, chercheur CR1 à l’INSERM, et Xavier Morandi, neurochirurgien et Professeur d’anatomie, tous deux membres de l’équipe VisAGeS.
Newsletter
Le responsable de ce traitement est Inria. En saisissant votre adresse mail, vous consentez à recevoir chaque mois une sélection d'articles et à ce que vos données soient collectées et stockées comme décrit dans notre politique de confidentialité
Niveau de lecture
Aidez-nous à évaluer le niveau de lecture de ce document.
Votre choix a été pris en compte. Merci d'avoir estimé le niveau de ce document !

Christine Leininger
Cheffe de projet médiation scientifique à la direction de la culture et de l'information scientifiques d'Inria.