L’air et le sang : les écoulements in vivo
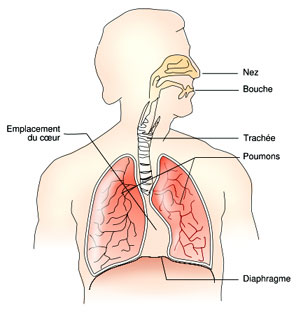
Système respiratoire
Source : Theresa Knott / Wikipédia
Qui n’a jamais rêvé de voyager à l’intérieur du corps humain, d’observer le mouvement de l’air dans les poumons ou encore de voir la poussée du sang gonfler les artères au rythme des battements du cœur ? Désormais, grâce aux modélisations informatiques, cela devient possible : elles représentent les organes, leur fonctionnement mais aussi les fluides qui les parcourent ; elles aident au bilan diagnostique des pathologies et au contrôle de l’efficacité des traitements. Elles permettent l’analyse du comportement de l’organe dans son ensemble et parfois jusque dans des détails aussi fins que les interactions entre molécules. Ce comportement est ensuite décrit à l’aide de relations mathématiques et de paramètres, tout en gardant à l’esprit le précepte du philosophe anglais Guillaume d’Ockham (1280-1350) : « Pluralitas non est ponenda sine necessitate », la multiplication des éléments ne doit pas être utilisée sans nécessité. Il faut en effet se limiter à un nombre restreint de paramètres significatifs, afin de maîtriser la simulation, d’assurer un calcul rapide et d’interpréter efficacement les résultats.
La tâche est rude, car le corps humain est le fruit de 3,8 milliards d’années d’évolution, au cours desquelles l’être monocellulaire a évolué vers l’organisme composite d’aujourd’hui. Un système physiologique a une structure complexe et ses composants sont de nature diverse. Il se transforme au cours de la vie d’un individu. Certains éléments sont redondants, pour éviter la dégradation de l’ensemble par l’altération de quelques-uns.
Comment appréhende-t-on un système physiologique dans son ensemble ? L’approche des modélisateurs n’est pas la même que celle des médecins. Ces derniers observent le malade et comparent son état à celui d’un sujet sain, suivant en cela une liste de faits répertoriés. Nous, les modélisateurs, nous nous comportons en physiciens : nous contournons les difficultés liées à la diversité, à la complexité et à la variabilité des organismes, par un choix approprié d’hypothèses et d’échelles. Nous ne conservons que les propriétés du système qui se rapportent au problème posé. En bref, nous approchons la réalité par une situation artificielle, un modèle.
« On ne pourra bien dessiner le simple qu’après une étude approfondie du complexe. »
( Gaston Bachelard )
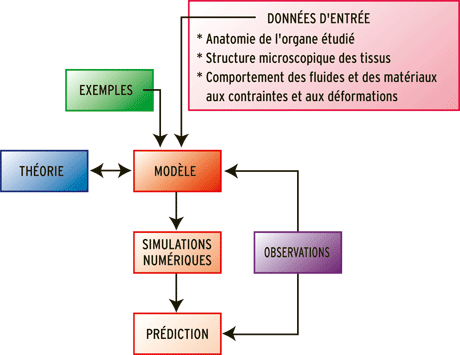
Un modèle s’inspire de théories physiques et d’observations. On émet des hypothèses simplificatrices et on déduit des observations les données d’entrée. Les simulations numériques prédisent, pour un jeu de données d’entrée, un résultat que l’on compare aux observations.
Infographie : Pour la Science
Le physicien qui modélise le fonctionnement du corps humain est comme un peintre devant un paysage : l’artiste observe longuement les lieux, choisit un point de vue, et joue avec les couleurs pour faire ressortir sur la toile des éléments du paysage. De façon similaire, le physicien identifie le problème et les objectifs, puis il collecte les informations sur le système. Il en fait la synthèse, c’est-à-dire qu’il élimine les informations a priori inutiles et caractérise les paramètres du système à déterminer. Dans le cas des écoulements physiologiques, trois types de données sont nécessaires : les propriétés physiques du fluide, l’architecture générale des vaisseaux, leurs dimensions et leurs propriétés rhéologiques (c’est-à-dire celles qui sont liées aux contraintes et aux déformations) et la nature de l’écoulement. Certaines variables n’ont pas de dimension, à l’inverse de la masse ou de la vitesse, car elles sont des rapports de forces. Parmi ces variables, la plus connue est le nombre de Reynolds, qui caractérise un écoulement et en particulier la nature de son régime (laminaire, transitoire ou turbulent, etc.). C’est le rapport entre les forces d’inertie (des forces de « convection » induites par le transport du fluide) et les forces visqueuses (liées aux interactions au sein même du fluide) mises en jeu. Quand ces dernières sont importantes, l’écoulement est dit laminaire ou régulier. Si les forces d’inerties deviennent prépondérantes alors on observe des turbulences.
La première étape consiste à attribuer des valeurs adéquates à ces paramètres et aux propriétés des matériaux biologiques. C’est délicat : les mesures in vitro ne reflètent pas la réalité, car on ne sait pas reproduire en laboratoire un système physiologique irrigué et soumis aux sollicitations de son environnement proche, comme le système nerveux central. Or négliger ces aspects conduit parfois à des estimations erronées.
Dans l’étape suivante, on représente le système par analogie. Les mécaniciens des fluides considèrent l’air et le sang comme un continuum déformable : il prend la forme du contenant et s’écoule. Ce fluide physiologique parcourt les bronches, ou les artères, que l’on considère comme un réseau dense de coudes, d’embranchements, de jonctions. Son écoulement est décrit en physique par les équations de Navier-Stokes, qui expriment les principes de conservation de la masse et de la quantité de mouvement. Ces équations sont issues d’une analyse des bilans dans un volume élémentaire infinitésimal. Quoique de taille minuscule, chacune de ces « boîtes » est composée d’une énorme quantité de molécules de fluide. Les propriétés moyennes de ces molécules à un instant t définissent celles du fluide dans chaque boîte. Toutefois les équations de Navier-Stokes sont des équations aux dérivées partielles non linéaires. Elles n’ont pas toujours de solutions analytiques. Le physicien recourt alors à une technique de résolution par approximation (la discrétisation). Il découpe le milieu continu (l’air ou le sang) en volumes de taille finie et variable : les surfaces deviennent un ensemble de polygones et les volumes, des polyèdres. À l’issue des calculs, on compare les résultats de la modélisation avec les observations cliniques ou les résultats d’expérimentations sur des maquettes.
Une bonne simulation est simple à comprendre et à utiliser. Fiable et robuste, elle évalue la réponse du système, même pour les valeurs extrêmes des paramètres. Elle s’adapte et évolue pour rendre compte de situations toujours plus complexes. Les simulations numériques ne décrivent pas seulement le comportement du système étudié pour un jeu fixé de données d’entrée. Le physicien teste le rôle de chaque grandeur impliquée en variant sa valeur et en maintenant toutes les autres constantes. En outre, les simulations lui fournissent l’évolution dans le temps et l’espace des différentes grandeurs physiques avec une résolution inégalée expérimentalement. Ainsi on atteint une compréhension fine et prédictive des phénomènes mis en jeu.
Dans les paragraphes suivants, nous allons nous intéresser à la modélisation des écoulements physiologiques à travers trois exemples. Le premier s’attache à l’écoulement de l’air dans les voies respiratoires : il met en évidence la limitation du débit d’air expulsé lorsqu’on force son expiration. Nous verrons que le modèle, bien que de structure différente de celle du système réel, présente un comportement similaire. Le deuxième modèle considère la lésion, plus ou moins étendue, de la paroi d’une artère, ce qu’on appelle un anévrisme, qui risque d’évoluer vers la rupture et le décès du sujet atteint. À l’aide des simulations, nous prédisons le comportement de l’artère et de la lésion avant et après traitement. Enfin, le troisième modèle s’intéresse à un cas similaire d’anévrisme et explique comment on peut adapter le modèle au patient, à partir d’images médicales. Développé en fonction de l’anatomie du patient, il apporte aux médecins des informations précieuses quant au choix de la thérapie la plus adaptée.
Le poumon monoalvéolaire
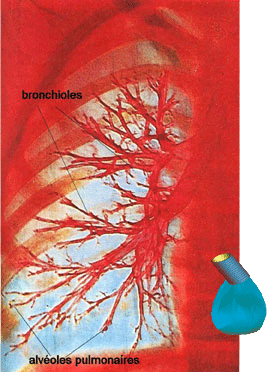
Le poumon se ramène-t-il à un sac relié à un tuyau ? À première vue, les structures sont différentes, mais en assimilant le sac aux échanges entre l’air et le sang et le tuyau à la trachée, aux bronches et aux bronchioles, on reproduit les caractéristiques de l’expiration pulmonaire.
Image : DR
Certains patients présentent des troubles de la respiration souvent liés à une amputation des volumes pulmonaires, ou à une réduction du calibre des bronches et à une altération des propriétés mécaniques du système. Les médecins différencient les deux types de pathologies à l’aide de l’expiration forcée : après avoir inspiré le volume pulmonaire maximal, le patient expire toute sa capacité vitale le plus rapidement possible. Ce test permet de détecter un trouble obstructif. En marge du diagnostic médical, les praticiens constatent que le débit atteint son maximum 80 à 200 millisecondes après le début de l’exercice, puis il décroît rapidement malgré le grand volume d’air qui reste à expirer. Cette observation est valable pour les sujets aussi bien sains que malades. Pour déterminer l’origine de ce phénomène, nous avons modélisé numériquement l’écoulement de l’air dans les conduits respiratoires, du fond des poumons jusqu’à la trachée. Cependant, nous avons négligé l’architecture et les dimensions de la trachée, des bronches et des bronchioles, et les avons assimilés à un tuyau déformable. Dans ce modèle, le diamètre du tube varie avec la différence de pression entre l’intérieur du tube et l’extérieur. Un réservoir déformable est raccordé à l’une des extrémités du tuyau. Il représente les régions des échanges gazeux entre l’air et le sang, à savoir les alvéoles pulmonaires.
La vitesse débitante du fluide, ici l’écoulement de l’air, est le paramètre qui nous intéresse. Selon la simulation, elle est égale à la célérité des ondes de pression dans la section de la trachée la plus étroite qui est située près de l’orifice en haut du thorax. Nous avons comparé ce résultat numérique avec des mesures réalisées chez des volontaires sains. Les grandeurs expérimentales et numériques suivent une évolution identique, et valident la modélisation.
À la lumière des résultats de la simulation, nous avançons dans la compréhension du fonctionnement des poumons et rejetons des notions erronées pourtant bien acceptées jusqu’alors. On pensait que l’effort exercé n’affectait pas le débit pendant la plus grande partie de l’expiration forcée, mais la simulation prouve le contraire. La valeur du débit dépend fortement de l’évolution des pressions. En outre, l’existence d’un écoulement critique n’est que transitoire. L’idée que les bronches de gros calibre influaient peu sur le débit à la fin du test est remise en cause, car nous avons montré le rôle essentiel de la déformation de la trachée. Notre modèle rend compte précisément des phénomènes physiques et se révèle être un moyen fructueux d’investigation et de réflexion, bien que sa structure ne soit pas réaliste.
L’anévrisme cérébral
Notre second sujet d’étude concerne l’anévrisme cérébral, c’est-à-dire une dilatation anormale de la paroi d’une artère. On observe soit un gonflement total du tronçon artériel en forme de fuseau, soit l’apparition d’une poche latérale. Ce second type de dilatation, dit sacculaire, se manifeste souvent à l’embranchement des gros vaisseaux situés à la base du cerveau. Au cours de son évolution, la paroi s’amincit, et la cavité s’agrandit jusqu’à plus de 25 millimètres.
Deux traitements sont possibles : le « clippage » neurochirurgical et le traitement endovasculaire par implantation de filaments. Dans le premier cas, le médecin place un petit « clip » en métal, une pince, à la base de l’anévrisme de manière à le fermer. Ainsi, il sépare l’anévrisme du reste du vaisseau sanguin. La seconde solution consiste à placer des filaments métalliques souples dans l’anévrisme. Pour cela, le médecin insère un long tube, un cathéter, dans l’artère de l’aine. Puis il le glisse avec précaution jusqu’au cerveau. Enfin, il fait passer à l’intérieur du cathéter des filaments de platine pour remplir la cavité et boucher l’anévrisme.
Pour étudier l’anévrisme, nous avons élaboré deux types de modèles : l’un bidimensionnel et l’autre tridimensionnel. Avec le premier, nous avons examiné ce qui se passe pour divers états de remplissage de l’anévrisme par des filaments métalliques : la cavité est vide, partiellement ou complètement obstruée. À chaque fois, les résultats montrent que des zones à forte pression dans la cavité entraînent la formation de nouvelles lésions aux environs de la première. Ce constat est en accord avec les observations médicales.
Nous avons ensuite considéré l’influence de l’orientation de l’anévrisme : quand la cavité anévrismale a un col large et un axe parallèle à celui de l’artère, elle est très irriguée. Ainsi la pression à l’intérieur de la cavité est plus forte pour un anévrisme d’embranchement localisé sur la paroi en face de l’arrivée du sang que pour un anévrisme situé sur la paroi latérale de l’artère.
S’adapter au patient
 |
 |
 |
|
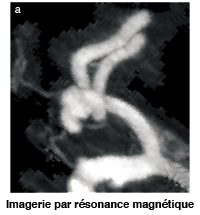
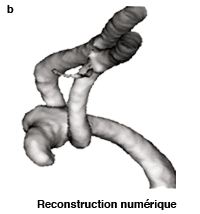
Modélisation d’un anévrisme. On prend une image du patient par scanner à rayons X (a). On en extrait la forme des artères qu’on reconstruit informatiquement puis on modélise la circulation sanguine. En (b), on peut voir un anévrisme qui forme une excroissance à l’embranchement de l’artère cérébrale moyenne. L’écoulement du sang applique une pression sur les parois de l’anévrisme. Les zones en orange sont celles où la pression est maximale dans la poche. Elles correspondent au dôme de l’anévrisme qui fait face au flux de sang entrant, ainsi qu’à la zone de transition de la bifurcation. Une de ces régions risque de rompre et de provoquer le décès du patient. |
||
À partir d’images médicales, on établit le second modèle qui est tridimensionnel et adapté au patient. L’imagerie médicale fournit des coupes des composantes anatomiques, que nous raccordons en un ensemble le plus cohérent et le plus fidèle possible. Reflétant l’état de l’organe à un instant donné, ces modèles orientent le choix thérapeutique : soit le médecin remplit la cavité, soit il la « clippe ». Dans le cas de l’anévrisme d’une branche de l’artère cérébrale moyenne, la modélisation signale une région de forte pression sanguine, à cheval sur le vaisseau lésé et la zone de transition de l’embranchement. Cette zone rend impossible tout traitement endovasculaire définitif, car il est fortement probable qu’une seconde lésion se forme au voisinage de la première. Cet anévrisme de la face latérale du cerveau est cependant d’accès aisé. Le patient bénéficie alors d’un traitement chirurgical par clippage, qui est la seule solution définitive.
Modèles et mesures
En mettant au point ces simulations, nous avons constaté qu’il fallait compléter le diagnostic par des mesures qui décrivent localement la circulation du sang (pression, répartition du débit entre les bronches, etc.). On détermine ces paramètres par imagerie à résonance magnétique ou ultrasons. Les comparaisons des résultats des simulations avec les observations cliniques ou réalisées sur des maquettes sont cependant satisfaisantes. Pour une utilisation quotidienne, il nous reste à améliorer la fiabilité de la reconstruction tridimensionnelle et à optimiser l’écriture informatique.
 |
 |
|
|
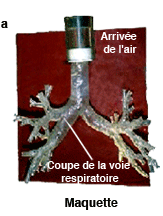
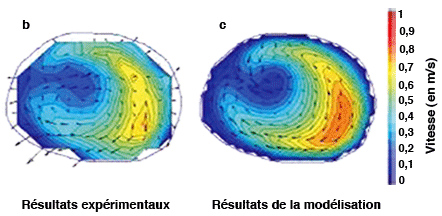
La modélisation des voies respiratoires est validée à l’aide de maquettes. On reproduit la géométrie des voies respiratoires sur une maquette en résine (a), et on y introduit de l’air à l’aide d’un piston. Lorsque le fluide ressort, on mesure sa vitesse, et on compare ces résultats expérimentaux (b) avec ceux de la simulation (c) pour un même endroit des voies respiratoires. La concordance entre les résultats numériques et les mesures physiques valide la simulation. |
||
Les modélisations présentées ici isolent une partie des voies respiratoires ou de la circulation sanguine. Les conditions aux limites ne sont donc pas rigoureusement respectées. Pour affiner le réalisme des modélisations, nous proposons de coupler les modèles détaillés à des modèles simplifiés des réseaux circulatoires. La modélisation du corps humain est en plein essor. Son rôle dépasse la compréhension du comportement des systèmes physiologiques : nous proposons des paramètres avec lesquels le médecin élabore un diagnostic précoce d’affections chroniques et dépiste des sujets à risque pour une maladie donnée, par exemple le développement d’un trouble obstructif dû au tabagisme. Les modélisateurs font aussi la démarche inverse : ils ajustent le modèle aux mesures physiologiques et estiment des paramètres inaccessibles in vivo. Les modèles aident aussi le médecin dans la planification thérapeutique et la surveillance de la lésion après traitement. Enfin, ils servent à la conception et à l’optimisation des dispositifs médicaux implantables et au développement de logiciels qui simulent les opérations médicales lors de l’apprentissage du métier de médecin interventionniste et de chirurgien (voir l’article Simulation de chirurgie hépatique, par H. Delingette et N. Ayache).
Quelques références vous sont proposées pour en savoir plus sur la modélisation des écoulements physiologiques.
En français
- M. Thiriet, Les anévrismes cérébraux
En anglais
- J.-D. Boissonnat et al., From arteriographies to computational flow in saccular aneurisms : the INRIA experience, in Medical Image Analysis, vol. 9, 2005
- C. Fetifa et al., An image-based computational model of oscillatory flow in the proximal part of tracheobronchial trees, in Computer Methods in Biomechanics and Biomedical Engineering, vol. 8, n° 4, 2005
- L. Vial et al., In vitro validation of CFD simulation in human proximal airways reconstructed from medical images with hyperpolarized helium-3 MRI phase contrast velocimetry, in Journal of Applied Physiology, à paraître
Une première version de cet article est parue dans le dossier n°52 La modélisation informatique, exploration du réel de la revue Pour la Science, numéro de juillet/septembre 2006.
Newsletter
Le responsable de ce traitement est Inria. En saisissant votre adresse mail, vous consentez à recevoir chaque mois une sélection d'articles et à ce que vos données soient collectées et stockées comme décrit dans notre politique de confidentialité
Niveau de lecture
Aidez-nous à évaluer le niveau de lecture de ce document.
Votre choix a été pris en compte. Merci d'avoir estimé le niveau de ce document !

Marc Thiriet