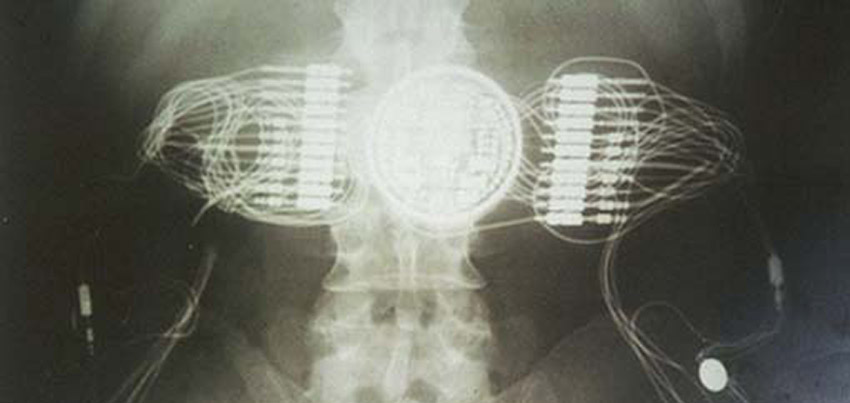
Restaurer la marche grâce à une puce
La rupture de la moelle épinière engendre souvent une paraplégie à cause d’un arrêt de la communication entre le centre nerveux et les muscles. Une voie de traitement consiste à activer les neurones moteurs. Mais pour ce faire, il faut comprendre comment la chaîne musculaire est activée ; quand les muscles doivent être stimulés, avec quelle intensité, pendant combien de temps ?
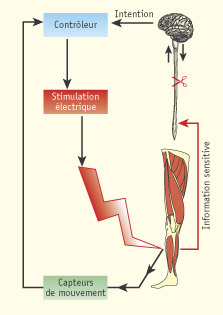
Quand la moelle épinière n’est plus en mesure de transmettre les ordres d’activation du cerveau aux muscles, on stimule ces derniers à l’aide d’impulsions électriques. Une boucle d’asservissement du mouvement relie des capteurs de mouvement à un contrôleur externe.
Infographie : Pour la Science
Certains mouvements, comme le passage de la position assise à la position debout chez un paraplégique, peuvent être programmés et appliqués au patient lorsque celui-ci décide de se lever. Pour des actions plus complexes, comme la gestion de l’équilibre en station debout, il est en plus nécessaire d’asservir le mouvement par des capteurs. L’approche scientifique est alors similaire à celle adoptée en robotique.
Système sensorimoteur et robotique
En effet, le système sensorimoteur est composé des mêmes éléments qu’un robot : des actionneurs, que sont les muscles, des capteurs sensibles à l’effort et à l’étirement, la vision, les inclinomètres de l’oreille interne, la sensibilité cutanée… et enfin une unité de traitement et de transport de l’information, essentiellement le système nerveux. Notre système sensorimoteur fonctionne sur les modes, connus en robotique, de la commande en boucle ouverte et fermée, ou la « téléopération », assimilable à l’action volontaire.
En fonctionnement naturel, le système nerveux central tient les commandes. Les aires corticales motrices et sensitives, le cervelet et la moelle épinière participent à l’élaboration et au transport des ordres d’activation des muscles. Le dernier relais est composé d’un ensemble de neurones – alpha motoneurones – situés dans la moelle épinière, et dont les axones se prolongent hors de celle-ci.
Il existe trois types de motoneurones : les motoneurones alpha, gamma et béta. Ce sont des cellules nerveuses connectées aux muscles, et qui commandent leur contraction à l’aide d’une impulsion nerveuse. Ces cellules peuvent interagir avec un plus ou moins grand nombre de fibres musculaires, l’ensemble étant appelé unité motrice.
Les motoneurones alpha, quant à eux, participent à l’innervation des fibres musculaires responsables de la contraction.
Ces axones se regroupent au sein des nerfs et en constituent la partie motrice. Ils se dirigent ensuite vers les muscles cibles et chaque axone atteint finalement un ensemble de fibres musculaires qui lui sont connectées via des synapses. Ainsi, le déclenchement d’un seul neurone provoque la contraction simultanée, une secousse, d’un ensemble de fibres au sein d’un même muscle : l’unité motrice. Plusieurs déclenchements successifs de ce même neurone provoquent plusieurs secousses, et si la fréquence de répétition est suffisante, environ 25 hertz, la contraction devient continue : c’est le tétanos. Le système nerveux module alors la force engendrée par le muscle selon la vitesse d’activation de chaque unité motrice, mais surtout selon le nombre d’unités motrices activées.
Pour la plupart des mouvements, un retour sensitif est nécessaire afin d’ajuster la commande musculaire. Nous possédons pour cela une série de capteurs qui renseignent le système nerveux central sur l’état du corps. Les boucles d’asservissement peuvent être réflexes, une piqûre plantaire provoquant un retrait du pied, ou peuvent contrôler un mouvement, tel le maintien de l’équilibre ou la saisie d’un objet. Sans capteur, nous serions incapables de réaliser ces mouvements.
Il s’agit d’un mécanisme tendant à réduire par comparaison successive l’écart entre la sortie du système et la sortie désirée. Pour atteindre une valeur désirée, le système observe le résultat d’une variation et en déduit quelle est la meilleure variation suivante pour atteindre la valeur désirée. Ce procédé très général rend un système robuste aux aléas ou aux erreurs du système qui se trouvent corrigés en temps réel. La motricité du corps humain est largement basée sur cette idée.
Stimuler les muscles
Lorsque la moelle épinière est sectionnée par accident, le système se retrouve coupé en deux parties qui ne communiquent plus. Les muscles dont les motoneurones se situent au-dessus de la lésion continuent de fonctionner normalement alors que les muscles dont les motoneurones sont détruits dégénèrent et ne produisent plus de mouvement. Mais les muscles dont les motoneurones sont situés au-dessous de la lésion, bien que non contrôlés par le cerveau, sont stimulables.
D’autres avant nous ont eu l’idée d’utiliser la stimulation électrique fonctionnelle pour restaurer des mouvements de membres paralysés. Le principe consiste à appliquer une impulsion électrique sur le nerf moteur qui engendre un potentiel d’action sur l’axone et induit ainsi une contraction d’une unité motrice.
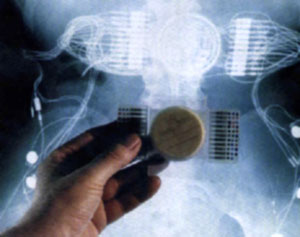
Puce électronique implantée dans les muscles : la radiographie montre l’implantation de la puce, les fils qui transportent le signal de stimulation et les électrodes placées sur les nerfs moteurs ou directement sur les muscles. Photo : © Pierre Rabischong
Des électrodes sont alors placées sur la peau, près des nerfs moteurs ou de leur point d’insertion dans le muscle. Le placement des électrodes étant délicat, il est préférable de recourir à une version implantée du système, ou neuroprothèse, en cas d’utilisation quotidienne.
L’implant central contenant une puce électronique productrice de stimulus, et les fils qui véhiculent ce signal jusqu’aux électrodes placées sur le nerf moteur sont positionnés par chirurgie. Cet ensemble est contrôlé de l’extérieur du corps par transmission radiofréquence. Nos recherches se concentrent sur la miniaturisation, et sur la génération de stimulus aux formes plus complexes. Nous avons aussi l’ambition de proposer une nouvelle génération de neuroprothèses sans fil : un réseau d’électrodes « intelligentes » capables de générer des stimulus, de communiquer avec les autres mais aussi avec le contrôleur extracorporel, et embarquant leur propre source d’énergie.
Modéliser le muscle
Restaurer un mouvement ne se limite pas à la contraction des muscles. Ces contractions doivent être ordonnées et modulées dans le temps, en séquences susceptibles de reproduire un mouvement, par exemple la marche. Le réglage empirique est fastidieux : il conduit à des résultats médiocres et dépend de chaque patient. L’ordinateur peut aider, à condition de définir au préalable un modèle mathématique qui décrit le fonctionnement de l’ensemble. Ses entrées correspondent aux séquences de stimulation et ses sorties aux mouvements de chaque articulation. On sait établir les modèles géométriques et dynamiques, qui rendent compte de la structure du squelette et de la répartition des masses, mais le modèle des « moteurs », les muscles, reste approximatif et difficile à paramétrer.
C’est pourquoi nous avons élaboré un modèle numérique du muscle, capable de prédire la force produite en fonction du stimulus reçu. Ainsi, pour une série de stimulations données, l’ordinateur calcule le mouvement généré. Du coup, il devient possible d’estimer, par des méthodes numériques d’optimisation, la séquence qui produira le mouvement désiré. Néanmoins, l’ordinateur n’y parvient que si le nombre de muscles impliqués reste petit.
Il reste à éprouver notre modèle de muscle par l’expérimentation. Un de ses défauts ? Il ne tient pas compte de la fatigue qui apparaît en quelques minutes sur un muscle paralysé : le mouvement généré diffère alors du mouvement désiré. Enfin, ce modèle est paramétré par des valeurs qu’il faut identifier sur chaque patient : longueur des muscles, masses, et autres données physiologiques. Les protocoles expérimentaux permettant d’obtenir ces valeurs ne sont pas encore au point, si bien que nombre de paramètres sont extraits d’abaques. Ceci éloigne d’autant la réponse du modèle de la réponse du muscle réel.
L’étape ultime de la génération de mouvement est son contrôle. Par exemple, la position debout équilibrée est instable et la moindre perturbation fait perdre cette position, de telle sorte que l’asservissement est nécessaire. Il faut observer l’inclinaison du tronc, l’angle des genoux et des chevilles, afin d’ajuster les stimulus des muscles extenseurs ou fléchisseurs des hanches, des genoux et des chevilles pour maintenir cet équilibre instable. Ce problème de contrôle constitue une vraie difficulté à la fois scientifique (trouver une commande stable et performante) et technique (concevoir des capteurs qu’un patient peut porter).
Dans toutes ces recherches, le patient joue un rôle essentiel. Il décide du mouvement, le ressent, et agit volontairement sur la partie du corps qui n’est pas paralysée. L’interface Homme-machine prend alors un sens tout à fait particulier, mais l’intégration de ces notions comportementales n’est pas encore à notre portée.
Notre objectif est d’améliorer la vie de ces personnes en attendant que des solutions meilleures, notamment biologiques, voient le jour. Nous ne remplacerons pas le fauteuil roulant, plus rapide, plus sûr et moins fatigant. Toutefois, marcher quelques pas avec un déambulateur, faciliter les transferts, se lever pour accéder à un objet situé en hauteur, contribuent à augmenter l’autonomie et améliorent la perception du degré de handicap. Ces techniques présentent d’autres avantages, comme le maintien du tonus musculaire, l’amélioration des transits et de la circulation sanguine, la diminution de la décalcification et donc du risque de fracture ainsi que la diminution des risques d’escarres. Ce travail nous occupera encore longtemps, mais dans ce domaine, chaque progrès est largement récompensé lorsqu’il change notablement la vie des patients.
Pour en savoir plus sur le projet DEMAR (Déambulation et mouvement artificiel).
Une première version de cet article est parue dans le dossier n°52 La modélisation informatique, exploration du réel de la revue Pour la Science, numéro de juillet/septembre 2006.
Newsletter
Le responsable de ce traitement est Inria. En saisissant votre adresse mail, vous consentez à recevoir chaque mois une sélection d'articles et à ce que vos données soient collectées et stockées comme décrit dans notre politique de confidentialité
Niveau de lecture
Aidez-nous à évaluer le niveau de lecture de ce document.
Votre choix a été pris en compte. Merci d'avoir estimé le niveau de ce document !
