Le cœur numérique
Le cœur est un organe complexe dont la fonction est d’assurer la circulation du sang dans l’organisme. Il est constitué du cœur droit et du cœur gauche, chacun étant formé de deux cavités : une oreillette et un ventricule. Le ventricule droit envoie le sang vers les poumons tandis que le gauche se charge d’alimenter le reste du corps, cette éjection résultant de la contraction du myocarde (tissu cardiaque).
Cette description est à présent connue de tous, mais le rôle du cœur dans le corps humain est resté longtemps mystérieux. Durant l’Antiquité, les Grecs y localisaient les manifestations de l’âme, puisque la fréquence des battements du cœur est corrélée avec les émotions ressenties. Galien et ses disciples, au IIe siècle, ont correctement distingué les 2 réseaux sanguins, artériel et veineux, mais rendaient les seules artères responsables de la circulation du sang, le cœur étant vu comme un aspirateur du sang plutôt qu’une pompe. Au Xe siècle, Avicenne, médecin philosophe d’origine perse, décrivit le rôle des ventricules et des valves cardiaques, mais ce fut Ibn al-Nafis, savant universel arabe du XIIe siècle, qui découvrit la circulation sanguine, en particulier la circulation pulmonaire. En Occident, 5 siècles plus tard, William Harvey compléta les travaux de Ibn al-Nafis en mettant en évidence le rôle des capillaires et en faisant une analyse quantitative de la fonction cardiaque.

Anatomie du cœur en 3D (© INRIA / Asclepios).
L’imagerie par résonance magnétique permet de reconstruire en 3D l’anatomie du cœur. Pour l’obtenir à partir de l’image réelle du cœur, on doit déterminer ses contours sur chaque coupe de l’image.
Grâce à l’imagerie médicale et en particulier à l’imagerie par résonance magnétique, il est possible de reconstruire en trois dimensions l’anatomie du cœur d’un patient. Sur cette illustration, les deux cavités principales du cœur, appelées ventricules, sont modélisées sous la forme d’un maillage. Celui-ci est constitué d’un grand nombre de tétraèdres (pyramides à 4 faces). Aux extrémités de chaque ventricule se trouvent deux valves qui laissent entrer ou sortir le sang dans la cavité. Le bruit de fermeture et d’ouverture de ces valves est caractéristique du fonctionnement de la pompe cardiaque. Pour obtenir cette reconstruction à partir de l’image médicale, il est nécessaire de déterminer les contours du cœur sur chaque coupe de l’image. Cette étape, appelée segmentation d’image, peut être manuelle ou assistée par un ordinateur. Elle est suivie par la création automatique du maillage dont on peut contrôler la taille et le nombre des éléments. Afin d’améliorer la précision du calcul, il est important d’obtenir des tétraèdres les plus réguliers possibles.
La connaissance de la physiologie du cœur a fait des progrès considérables depuis le XVIIe siècle, le siècle de Harvey, plus connu comme celui de Louis XIV. Conséquence positive de ce progrès, la prise en charge des maladies cardiovasculaires, première cause de mortalité en Occident, est en partie responsable de l’allongement de l’espérance de vie, inférieure à 25 ans au XVIIe siècle et supérieure à 80 ans de nos jours. En France, on dénombre cependant encore quelque 150 000 morts par an d’origine cardiovasculaire, soit un tiers du total des décès. Afin d’améliorer le diagnostic et la thérapie de ces maladies, mais aussi d’approfondir la connaissance de la fonction cardiaque, une nouvelle discipline scientifique s’est développée depuis près d’une vingtaine d’années : la modélisation numérique du système cardiovasculaire. L’objectif de ces modèles est de fournir une description mathématique, quantitative, objective et tridimensionnelle de la fonction cardiaque, complémentaire de celle utilisée traditionnellement dans la formation médicale, qui est littéraire, qualitative et graphique.
Pour simuler un cœur humain avec un ordinateur, il est nécessaire tout d’abord de déterminer les quantités physiques importantes dans le fonctionnement du cœur. Parmi ces grandeurs, on trouve par exemple le potentiel électrique, qui se propage dans le muscle cardiaque ou encore la position des parois du cœur, qui bougent lors de l’éjection du sang. Ces quantités sont appelées « variables d’état », car elles décrivent l’état du cœur à un instant donné. L’évolution de ces variables physiques au cours du cycle cardiaque est ensuite décrite par des équations mathématiques, qui doivent respecter les principes connus de la physique. Enfin, il faut transformer ces équations de façon à ce qu’elles puissent être manipulées par un ordinateur. Pour cela, on découpe le cœur en volumes élémentaires, et on discrétise les équations de la physique en de nouvelles équations valables pour chaque volume. L’ordinateur peut alors calculer l’évolution d’un cœur numérique.
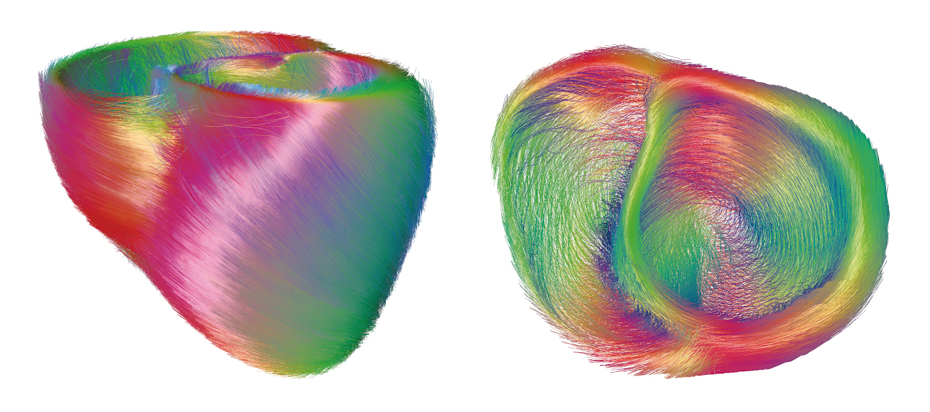
Les myocytes du cœur (© INRIA / Asclepios).
L’imagerie par résonance magnétique et en particulier l’imagerie dite de « tenseur de diffusion » permet l’observation de la structure des fibres du cœur. Celles-ci s’enroulent autour de l’axe du cœur.
Le cœur est un muscle constitué de minuscules fibres appelées myocytes. Ces structures allongées sont organisées de manière à maximiser l’éjection du sang depuis les ventricules lors de la contraction cardiaque. Ainsi, ces fibres ont une orientation qui varie entre la surface externe et interne des ventricules et elles s’enroulent autour du grand axe du cœur. Il est à présent possible d’observer cette structure des fibres grâce à l’imagerie par résonance magnétique (IRM) et en particulier l’imagerie dite de « tenseur de diffusion ». L’analyse de données acquises de plusieurs cœurs, permet d’estimer la forme moyenne de ses fibres au sein d’une population. La figure ci-dessus correspond à un traitement informatique de la forme moyenne de cœurs canins.
Bien sûr, mettre au point une telle description universelle relève de l’utopie, tant la machine cardiaque est complexe. Une première source de complexité vient du fait que plusieurs phénomènes physiques et chimiques entrent en jeu lors d’un battement cardiaque. En effet, la contraction est contrôlée par la propagation, des oreillettes aux ventricules, d’une onde dite de dépolarisation électrique. Celle-ci est induite par la dépolarisation de proche en proche des cellules musculaires (passage d’un potentiel négatif à une valeur positive), qui ensuite se repolarisent, et ainsi de suite. La capacité du tissu cardiaque à se contracter dépend aussi de l’apport d’oxygène aux cellules par les artères coronaires (perfusion). Enfin, la pression et le débit du sang dans les artères, les veines et les cavités cardiaques commandent la contraction et la relaxation du muscle cardiaque et en résultent tout à la fois. Tous ces phénomènes physiques (électrophysiologie, perfusion, mécanique des fluides et des structures) sont donc intimement couplés les uns aux autres et sont essentiels à la compréhension du système cardio-vasculaire.
Autre source de complexité, les principes physico-chimiques impliqués interviennent à des échelles de temps et d’espace très étendues. Par exemple, pour comprendre les troubles du rythme cardiaque, il est indispensable de bien comprendre les migrations d’ions qui interviennent au niveau de la cellule cardiaque dont la taille est de l’ordre de plusieurs microns (10-6 m). Par contre, les régions du cœur altérées à la suite d’un infarctus du myocarde ont une taille de l’ordre du centimètre (10-2 m). De même, le cycle cardiaque a une durée de l’ordre de la seconde, mais l’évolution de la forme du cœur après une intervention chirurgicale (phénomène appelé remodelage) s’établit sur plusieurs semaines. Enfin, le dernier obstacle à surmonter pour la modélisation numérique du cœur est l’infinie variabilité de forme et de comportement qui existe entre les individus, en raison de la génétique, mais aussi de la présence de maladies cardiaques.
Malgré ces difficultés, les travaux de recherche sur la modélisation physique et physiologique du cœur ont débuté, il y a près de quarante ans, au sein de l’université d’Oxford en Grande-Bretagne, ainsi qu’à l’institut de Bio-ingénierie de l’université d’Auckland en Nouvelle-Zélande.
Ils se sont amplifiés depuis lors, dans plusieurs autres centres de recherche, dont l’INRIA en France, qui a lancé l’action CardioSense3D en 2005. Les objectifs en sont à la fois plus modestes et plus ciblés que ceux énoncés précédemment. Plutôt que de décrire de manière universelle le fonctionnement du cœur, ces recherches se concentrent principalement sur les phénomènes électriques et mécaniques intervenant à l’échelle macroscopique (à l’échelle des tissus et non de la cellule). Par ailleurs, en vue d’améliorer le diagnostic et la thérapie de malades souffrant de maladies cardiovasculaires, on cherche à personnaliser ces modèles numériques, c’est-à-dire à représenter le cœur d’un patient à partir de données acquises lors d’examens cliniques. Par exemple, la fréquence cardiaque et la pression sanguine sont couramment acquises lors d’un examen médical et fournissent des renseignements quantitatifs sur le flot sanguin et le battement du cœur d’un patient. De même, l’imagerie échographique, scanner ou par résonance magnétique fournit des informations en trois dimensions sur l’anatomie du cœur et des vaisseaux sanguins, mais aussi sur le mouvement cardiaque. Enfin, l’électrocardiogramme ou encore l’exploration électrophysiologique par cathéters permettent de connaître la forme et la vitesse des ondes électriques parcourant le cœur.
Ainsi, en fonction d’hypothèses sur la condition du cœur d’un patient, on en construit un modèle numérique en s’aidant des données disponibles. Le premier objectif du modèle est de reproduire fidèlement les observations visibles dans les images médicales. Le second objectif, plus ambitieux, est d’utiliser ce modèle pour prédire l’évolution de maladies cardiaques ou encore de mieux planifier une intervention thérapeutique (chirurgie, prise de médicaments…).
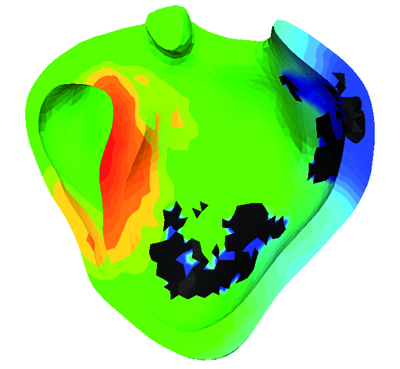
Simulation de l’activité électrique dans les 2 ventricules cardiaques (© INRIA / Asclepios).
La simulation de l’activité électrique dans les ventricules d’un patient permet de voir, sur les zones sombres, les tissus nécrosés dus à un infarctus du myocarde et qui conduisent moins bien les ondes électriques.
Simulation de l’activité électrique dans les 2 ventricules cardiaques d’un patient dont l’anatomie a été reconstruite à partir d’une image IRM. La couleur indique le temps de passage de l’onde électrique, les couleurs chaudes indiquant le lieu où la dépolarisation est la plus précoce. Les zones sombres correspondent à des cicatrices constituées de tissu nécrosé suite à un infarctus du myocarde. Elles ont la particularité de conduire faiblement les ondes électriques et peuvent être responsables de troubles du rythme tels que la tachycardie ventriculaire. En effet, elles perturbent la propagation de la vague électrique et peuvent créer des « tourbillons » électriques qui tournent autour de ces cicatrices et diminuent l’efficacité de la pompe cardiaque.
Pour mettre en œuvre un modèle numérique du cœur, il faut tout d’abord définir un domaine de calcul sous la forme d’un maillage tridimensionnel. Ce maillage est reconstruit à partir d’images médicales du patient et sa taille varie de quelques dizaines de milliers à quelques millions d’éléments, en fonction de la nature des phénomènes que l’on cherche à simuler. Sur ce maillage, il est nécessaire d’ajouter des informations anatomiques comme l’emplacement des valves cardiaques ou encore l’orientation des fibres cardiaques. En effet, le cœur est un muscle constitué de minuscules fibres qui se contractent et se relâchent durant le cycle cardiaque. Ces fibres s’enroulent autour des cavités cardiaques et leur structure joue un rôle important pour la mécanique et l’électrophysiologie cardiaques.
En plus de ce domaine de calcul, on définit des équations mathématiques qui représentent les phénomènes physiques, généralement couplés, que l’on souhaite étudier. Ces équations définissent comment certaines variables, comme le potentiel électrique ou la position d’un point du ventricule gauche, évoluent au cours du cycle cardiaque. Bien sûr, les équations incluent des paramètres comme la diffusivité électrique ou la raideur du muscle, dont la valeur influence l’évolution des grandeurs physiques.
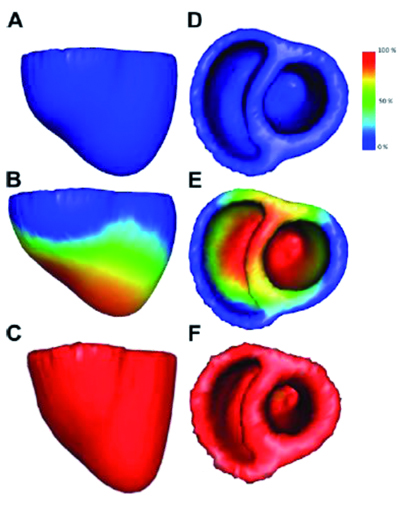
Simulation de la contraction des 2 ventricules cardiaques depuis la phase de remplissage (A et D) vers la phase d’éjection (C et F) (© INRIA / Asclepios).
Ces équations sont ensuite discrétisées sur le domaine de calcul et sont résolues par ordinateur. Pour simuler les quatre phases (remplissage, contraction, éjection et relaxation) d’un seul battement du cœur, dont la durée est de l’ordre de la seconde, il faut entre 10 minutes et plusieurs heures de calcul, en fonction de la complexité du modèle. Pour personnaliser le modèle, il faut enfin estimer les paramètres des équations, afin que la simulation corresponde aux observations disponibles pour un patient donné. C’est un problème difficile, car il est hors de question de tester toutes les combinaisons de paramètres possibles. D’où l’idée de faire appel à des méthodes d’assimilation de données, plus couramment utilisées dans d’autres domaines, comme la météorologie. Elles consistent à affiner le modèle de manière itérative jusqu’à minimiser l’écart entre les quantités simulées et les quantités observées : volume de sang éjecté, électrocardiogramme…
La validation de tels modèles est un travail de longue haleine, qui mobilise des experts en informatique, traitement d’images, mathématiques appliquées, mais aussi des médecins cardiologues. Une première étape de cette validation consiste à simuler numériquement le battement du cœur dans des situations normales et en présence de pathologies cardiaques, puis de vérifier qu’il y a une bonne adéquation entre le comportement simulé et celui décrit par les experts en cardiologie. Une seconde étape permet de tester le caractère prédictif du modèle. Pour cela, on personnalise un modèle du cœur à partir de données (images et signaux bioélectriques) d’un patient et on prédit le comportement cardiaque, lorsque celui-ci est soumis à une thérapie ou de nouveaux stimuli. Par exemple, une procédure courante en cardiologie consiste à stimuler artificiellement le cœur à l’aide de sondes de stimulation (appelées aussi pacemakers). Des travaux récents effectués par l’INRIA et l’hôpital Saint-Thomas de Londres, ont ainsi pu montrer sur un petit nombre de patients qu’un modèle électromécanique du cœur pouvait prédire le comportement mécanique du cœur résultant de stimulations artificielles. À terme, une application de ces travaux pourrait donc être l’optimisation de la pose de stimulateurs cardiaques, mais aussi une meilleure sélection des patients susceptibles de bénéficier de cette thérapie. D’autres applications sont envisagées telle une meilleure prise en charge des patients souffrant de troubles du rythme, grâce à une planification plus précise de l’ablation par radiofréquence de tissus cardiaques.
- Action de recherche CardioSense3D
- Équipe-projet Asclepios
Cet article est paru dans la revue DocSciences n°13 Informatique et médecine, éditée par le CRDP de l’Académie de Versailles en partenariat avec l’INRIA.
Newsletter
Le responsable de ce traitement est Inria. En saisissant votre adresse mail, vous consentez à recevoir chaque mois une sélection d'articles et à ce que vos données soient collectées et stockées comme décrit dans notre politique de confidentialité
Niveau de lecture
Aidez-nous à évaluer le niveau de lecture de ce document.
Votre choix a été pris en compte. Merci d'avoir estimé le niveau de ce document !

Hervé Delingette
Directeur de recherche Inria en simulation et analyse d'images médicales dans l'équipe ASCLEPIOS.

Maxime Sermesant